Caja de información
3.1.1. CONCEPTO DE ENLACE QUÍMICOS.
3.1.2. CLASIFICACIÓN DE LOS ENLACES QUÍMICOS
3.1.3. APLICACIONES Y LIMITACIONES DE LA REGLA DEL OCTETO
3.2. ENLACE COVALENTE
3.2.1. TEORÍAS PARA EXPLICAR EL ENLACE COVALENTE Y SUS ENLACES
3.2.1.1. TEORÍAS DEL ENLACE DE VALENCIA
3.2.1.2. HIBRIDACIÓN Y GEOMETRÍA MOLECULAR
3.2.1.3. TEORÍA DEL MOLECULAR ORBITAL
3.3. ENLACE IÓNICO
3.3.1. FORMACIÓN Y PROPIEDADES DE LOS COMPUESTOS IÓNICOS
3.3.2. REDES CRISTALINAS.
3.3.2.1. ESTRUCTURA
3.3.2.2. ENERGÍA RETICULAR.
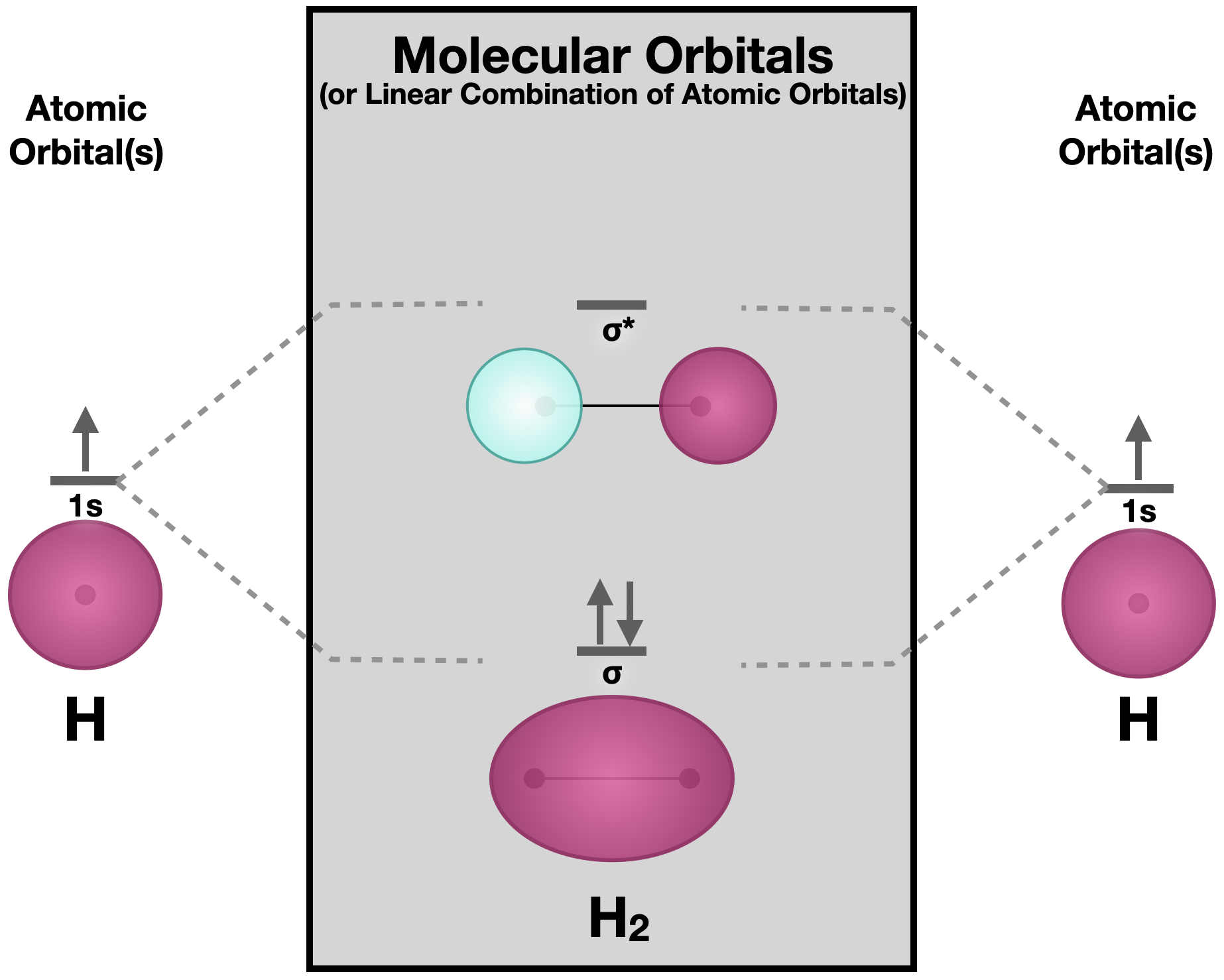
3.2.1.3. TEORÍA DEL MOLECULAR ORBITAL
Existen electrones considerados parte de esa coreografía, en lugar de pertenecer a
un átomo especifico, estos se pueden mover con libertad entre los orbitales moleculares
abarcando la molécula completa.
Suponiendo que los átomos son personas bailando en la pista, cada uno tiene
un estilo propio de baile, representado por movimientos individuales,
estos son orbitales atómicos.
Ahora cuando las dos personas se acercan, ya pueden bailar juntos, pero en lugar
de seguir los movimientos propios, estos combinan sus estilos de bailes creando
una coreografía, a esto se le puede considerar, orbita molecular.
La energía y forma de los orbitales determinan el comportamiento de la molécula,
por ejemplo, algunos pueden tener mas electrones en rotación esto significa que
sea una molécula estable.
Con esto podemos determinar que esta teoría nos ayuda a poder comprender el
movimiento y comportamiento de los electrones en una molécula, en como también
estos crean orbitales abarcando toda una estructura y determinando sus propios
comportamientos y propiedades.