Unidad 3
3.1.1. CONCEPTO DE ENLACE QUÍMICOS.
3.1.2. CLASIFICACIÓN DE LOS ENLACES QUÍMICOS
3.1.3. APLICACIONES Y LIMITACIONES DE LA REGLA DEL OCTETO
3.2. ENLACE COVALENTE
3.2.1. TEORÍAS PARA EXPLICAR EL ENLACE COVALENTE Y SUS ENLACES
3.2.1.1. TEORÍAS DEL ENLACE DE VALENCIA
3.2.1.2. HIBRIDACIÓN Y GEOMETRÍA MOLECULAR
3.2.1.3. TEORÍA DEL MOLECULAR ORBITAL
3.3. ENLACE IÓNICO
3.3.1. FORMACIÓN Y PROPIEDADES DE LOS COMPUESTOS IÓNICOS
3.3.2. REDES CRISTALINAS.
3.3.2.1. ESTRUCTURA
3.3.2.2. ENERGÍA RETICULAR.
3.1.3. APLICACIONES Y LIMITACIONES DE LA REGLA DEL OCTETO
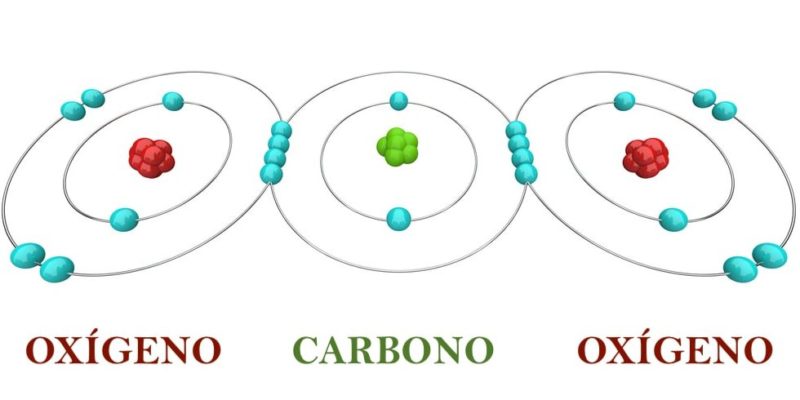
¿Qué es la regla del octeto?
Establece que los iones de los distintos elementos químicos que se encuentran en la Tabla Periódica suelen completar sus últimos niveles de energía con 8 electrones. Debido a esto, las moléculas pueden adquirir una estabilidad semejante a la de los gases nobles (ubicados al extremo derecho de la tabla periódica), cuya estructura electrónica (con su último nivel de energía completo) los hace muy estables, o sea, poco reactivos.
Así, los elementos de alta electronegatividad (como los halógenos y anfígenos, es decir, elementos del grupo 16 de la Tabla) tienden a “ganar” electrones hasta alcanzar el octeto, mientras que los de baja electronegatividad (como los alcalinos o alcalinotérreos) tienden a “perder” electrones para alcanzar el octeto.
Es aquella que sucede cuando la unión que se realiza se produce entre átomos de cargas distintas, es decir, se produce la unión de los átomos con carga positiva (o conocida en la química como no electronegativa) y los átomos con carga negativa (o bien llamados en el argot de la ciencia como átomos electronegativos).
Cumplimiento de la regla del octeto
La regla del octeto se aplica principalmente a los elementos representativos, es decir, a los de los bloques s y p de la tabla periódica. Esta regla se aplica de forma consistente a los compuestos que contienen carbono, nitrógeno, oxígeno y halógenos, y con algunas excepciones a los demás elementos del bloque p. Sin embargo, la mayoría de los metales de transición no la cumplen.